Ostry czubek z atomu żelaza
Rozpoczynając atak na bakterie, bakteriofagi nakłuwają je za pomocą kurczliwego białka. Ponieważ jest ono mikroskopijne, długo nie wiedziano, jak działa i jest zbudowane. Teraz odkryto, że na jego czubku tkwi pojedynczy atom żelaza, utrzymywany w miejscu przez 6 aminokwasów.
Biofizyk Petr Leiman z Politechniki Federalnej w Lozannie podkreśla, że sporo wiadomo o namnażaniu bakteriofagów, ale już nie o początkowych etapach zakażania ofiar. Stąd pomysł na eksperymenty z dwoma bakteriofagami P2 i Φ92, które atakują pałeczki okrężnicy (Escherichia coli) oraz bakterie z rodzaju Salmonella.
Naukowcy odnaleźli w przeszłości gen odpowiedzialny za tworzenie białkowego "szpikulca" P2, teraz udało się to w odniesieniu do Φ92. W kolejnym etapie badań Szwajcarzy wyprodukowali oba białka i przekształcili je w kryształy. Dzięki temu do określenia budowy protein mogli się posłużyć krystalografią rentgenowską (promienie rentgenowskie ulegają dyfrakcji na kryształach, a wiązki ugięte rejestruje się za pomocą liczników, ewentualnie błony fotograficznej).
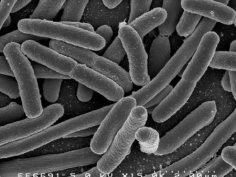
Mimo że uważano, że krystalografia rozwieje wszelkie wątpliwości związane ze strukturą kurczliwego białka wirusów, tak się jednak nie stało. Podczas prób zrekonstruowania "szpikulca" na podstawie dyfraktogramu okazało się, że brakuje najważniejszego elementu - czubka. Akademicy zmodyfikowali więc gen bakteriofagów w taki sposób, by produkowana była tylko część białka stanowiąca czubek. Po kolejnej krystalografii rentgenowskiej określono wreszcie, jak wygląda i pod mikroskopem elektronowym wykonano zdjęcie dokumentujące przebieg nakłuwania błony zewnętrznej bakterii Gram-ujemnych.


Komentarze (2)
waldi888231200, 28 lutego 2012, 01:28
Ciekawe jak im się to udało??
Gość Matsukawa, 28 lutego 2012, 12:48