Bakterie mikrobiomu akumulują się w guzie i wspomagają terapię przeciwnowotworową
Bifidobacteria - bakterie mikrobiomu - akumulują się w guzach nowotworowych i zwiększają skuteczność immunoterapii u myszy. Wyniki, które opisano na łamach Journal of Experimental Medicine (JEM), sugerują, że w przyszłości leczenie chorych onkologicznie tymi bakteriami może zwiększyć ich reakcję na terapię przeciwciałami anty-CD47.
Obecność CD47 na komórkach nowotworowych hamuje ich fagocytozę. Hamowanie tego białka mogłoby pozwolić układowi odpornościowemu pacjenta zaatakować i zniszczyć guz. Obecnie przeciwciała anty-CD47 są testowane w ramach licznych testów klinicznych. Badania na myszach laboratoryjnych dawały jednak mieszane rezultaty: niektóre gryzonie reagowały na terapię, inne nie.
By ustalić, czy skuteczność terapii zależy od mikrobiomu jelitowego myszy, naukowcy UT Southwestern i Uniwersytetu w Chicago posłużyli się myszami typu dzikiego z 2 instytucji: Jackson Laboratory (Jax) i Taconic Biosciences (Tac); wcześniej zauważono, że mają one unikatową mikroflorę jelitową, która przyczynia się do unikatowych sygnatur immunologicznych.
Amerykanie zaobserwowali, że myszy Jax z guzem reagowały na blokadę CD47, a myszy Tac nie. Chcąc ustalić, czy reakcja na immunoterapię anty-CD47 zależy do mikroflory jelitowej, naukowcy kohodowali wszystkie zwierzęta przez 3 tygodnie. Okazało się, że później obie grupy podobnie odpowiadały na blokadę CD47. To pokazuje, że transfer bakterii komensalnych od myszy reagujących (Jax) - oralnie albo przez kontakt fizyczny - pozwala uzyskać reakcje przeciw guzowi u gryzoni wcześniej niereagujących.
W kolejnym etapie eksperymentu przed zaszczepieniem guza myszom Jax i Tac podano koktajl z antybiotyków. Stwierdzono, że myszy Jax nie reagowały na terapię anty-CD47.
By w jeszcze inny sposób potwierdzić znaczenie mikrobiomu, Amerykanie wykorzystali myszy nieposiadające flory bakteryjnej, tzw. myszy akseniczne (ang. germ free mice, GF). One także nie reagowały na terapię przeciwciałami anty-CD47.
Podanie antybiotyków wpływało na społeczności bakteryjne z różnych części organizmu. Antynowotworowa skuteczność immunoterapii anty-CD47 bazuje zaś na niemal całkowitej blokadzie CD47 w mikrośrodowisku guza (chodzi o wyłączenie oddziaływań systemowych i ograniczenie ich do mikrośrodowiska guza). By określić lokalizację antynowotworowych oddziaływań bakterii wchodzących w interakcję z blokadą CD47, zespół podawał więc niewielkie dawki antybiotyków bezpośrednio do tkanki guza. Doguzowe iniekcje zmniejszały skuteczność terapii anty-CD47 u reagujących wcześniej myszy.
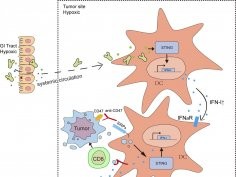
Bifidobacteria migrują do guzów i aktywują szlak zależny od STING (STING, od ang. stimulator of interferon genes, to białko stymulujące geny interferonu). Skutkuje to produkcją cząsteczek sygnałowych i aktywacją komórek odpornościowych. W połączeniu z terapią anty-CD47 te aktywowane komórki mogą atakować i niszczyć otaczający guz.
Ekipa podkreśla, że gdy u myszy niereagujących zastosowano suplementację bifidobakteriami, leczenie anty-CD47 stało się skuteczne. Warto przypomnieć, że wcześniejsze badania zademonstrowały, że Bifidobacteria wpływają korzystnie na chorych z wrzodziejącym zapaleniem jelita grubego.
Nasze studium pokazuje, że kolonizując guz, specyficzni reprezentanci mikrobiomu jelitowego zwiększają przeciwnowotworową skuteczność terapii anty-CD47. Podanie specyficznych gatunków bakterii albo ich opracowanych w laboratorium wersji może być nową strategią modulowania różnych [form] immunoterapii - podkreśla Yang-Xin Fu.
Nasze wyniki otwierają nową ścieżkę badań nad wpływem bakterii z guzów. Mogą pomóc w wyjaśnieniu, czemu niektórzy pacjenci nie reagują na immunoterapię - podsumowuje Ralph R. Weichselbaum.



Komentarze (0)