Białko bakteryjne może pomóc w wychwytywaniu metali ziem rzadkich
Naukowcy z Uniwersytetu Stanowego Pensylwanii opisali białko bakteryjne, które wykazuje 100 mln razy większą wybiórczość w stosunku do lantanowców (wykorzystywanych m.in. w smartfonach metali ziem rzadkich) niż do innych metali, np. wapnia.
Ponieważ właściwości fizyczne metali ziem rzadkich są bardzo zbliżone, trudno obrać na cel i zebrać tylko jeden konkretny. Zrozumienie, jak wspomniane białko wiąże się z lantanowcami z tak ogromną wybiórczością, może wskazać metody ich detekcji - podkreśla prof. Joseph Cotruvo Jr.
Naukowcy wykryli białko, które nazwali lanmoduliną, w bakterii Methylobacterium extorquens. Występuje ona na liściach i w glebie i odgrywa ważną rolę w obiegu węgla w środowisku. M. extorquens potrzebują lantanowców do prawidłowego działania enzymów, także tych pomagających w przetwarzaniu węgla.
Te bakterie potrzebują lantanowców i innych metali, takich jak wapń, do wzrostu. Niezbędne są im metody na pozyskanie wszystkich metali ze środowiska i upewnienie się, że każdy dociera do właściwego miejsca w komórce. Wydaje się, że M. extorquens wypracowały sobie unikatowy sposób na docieranie do lantanowców w otoczeniu, w którym pierwiastki te są o wiele rzadsze niż np. wapń - opowiada Cotruvo.
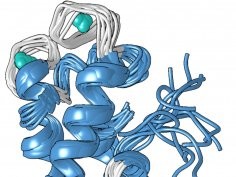
Unikatowa budowa białka, którą Cotruvo określił we współpracy z kolegą z uczelni Scottem Showalterem, może wyjaśniać, czemu lantanowce wiąże ono 100 mln razy lepiej niż wapń. Pod nieobecność metalu białko jest w dużej mierze nieustrukturowane, ale gdy metal występuje, zmienia konformację na kompaktową, dobrze ustrukturowaną.
W nowej kompaktowej formie występują 4 motywy "EF-hand". Ludzkie komórki zawierają wiele białek z tymi motywami strukturalnymi; biorą one udział w funkcjach wymagających wykorzystania wapnia, np. w skurczach mięśni czy wyładowaniach neuronów. Białka te wiążą także lantanowce, ale ponieważ u ludzi pierwiastki z tej grupy nie są fizjologicznie istotne, prawdopodobieństwo związania z lantanowcem jest maksymalnie tylko 100 razy większe niż dla wapnia.
W kompaktowej formie lanmoduliny w każdym motywie EF-hand w unikatowej pozycji występuje aminokwas prolina. Amerykanie uważają, że może się to przyczyniać do wybiórczości białka w stosunku do lantanowców.
Mechanizm wybiórczości w stosunku do lantanowców nie jest jasny, ale sądzimy, że wszystko sprowadza się do strukturalnej zmiany zachodzącej w obecności metalu [zależnej od metalu zmiany konformacji]. Strukturalna zmiana jest istotna dla działania białka; niektóre interakcje mogą wystąpić np. tylko przy jego kompaktowej postaci. By wywołać zmianę konformacji, potrzeba bardzo małej ilości lantanowców i o wiele większej, wykraczającej poza możliwości bakterii, ilości wapnia.
Zrozumienie selektywności białka może pomóc w gromadzeniu lantanowców do celów przemysłowych, w tym w ekstrakcji ze ścieków kopalnianych.



Komentarze (0)