Po raz pierwszy obserwowano składanie wirusa w czasie rzeczywistym
Po raz pierwszy sfilmowano proces składania wirusów (obudowywania nici RNA kapsydem). Wyniki badań z wykorzystaniem mikroskopii bazującej na interferometrii laserowej zapewniają świeże spojrzenie na metody zwalczania wirusów. Mogą też wiele wnieść do inżynierii samoskładających się cząstek.
Biologia strukturalna pozwoliła uwidocznić budowę wirusów z niesamowitą rozdzielczością, do poszczególnych atomów w białkach. Dotąd jednak nie wiedzieliśmy, jak właściwie zachodzi samoskładanie. Nasza technika [...] ujawniła kinetykę i szlaki [tego procesu] - podkreśla prof. Vinothan Manoharan z Uniwersytetu Harvarda.
Zespół Manoharana skupił się na wirusach RNA z pojedynczą nicią. Należą do nich takie wirusy, jak wirus Zachodniego Nilu czy wirus polio.
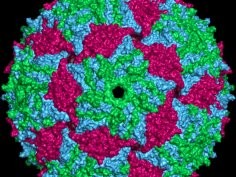
Autorzy artykułu z pisma Proceedings of the National Academy of Sciences (PNAS) zajęli się bakteriofagiem atakującym pałeczki okrężnicy (Escherichia coli) - MS2. MS2 ma 27-28 nanometrów średnicy. Jego nić RNA składa się z 3569 nukleotydów. Genom MS2 koduje m.in. cistron C dla białka kapsydu (w kapsydzie znajduje się 180 molekuł tego białka). Białka samoaranżują się w heksagony i pentagony, by ostatecznie utworzyć wokół RNA strukturę o charakterystycznym kształcie.
Dotąd nikt nie był w stanie zaobserwować składania wirusa w czasie rzeczywistym, bo wirusy i ich komponenty są bardzo drobne, a interakcje między podjednostkami bardzo słabe i zależne od parametrów roztworu.
By móc śledzić wirusy, naukowcy posłużyli się mikroskopią iSCAT (od ang. interferometric scattering microscopy). Technika ta nie ujawnia struktury wirusa, ale pokazuje jego rozmiary i jak zmieniają się one w czasie (światło rozproszone na obiekcie tworzy ciemny punkt).
Podczas eksperymentu naukowcy mocowali nici RNA do podłoża i do kuwety przepływowej wprowadzali dimery białek kapsydu. Następnie dzięki iSCAT byli świadkami pojawienia się czarnych punktów, które rosły i ciemniały, aż osiągały rozmiary "gotowego" faga.
Niektóre kapsydy składały się w mniej niż minutę, innym zajmowało to 2-3 min, a niektóre potrzebowały ponad 5 min. Kiedy jednak zaczynały się składać, nie zawracały [z obranej drogi]. Rosły, aż były gotowe.
Naukowcy porównali te obserwacje z wynikami wcześniejszych symulacji, które przewidywały 2 typy szlaków składania. W jednym z nich białka najpierw losowo przywierają do RNA, a potem rearanżują się w kapsyd. W drugim, nim kapsyd może urosnąć, na wirusowym RNA musi się uformować masa krytyczna białek (jądro).
Wyniki eksperymentów pasowały do drugiego wariantu (pierwszy wykluczono). U różnych wirusów jądro tworzy się w różnym czasie, ale kiedy do tego dojdzie, wirus rośnie szybko i nie przestaje, aż osiągnie właściwą wielkość.
Amerykanie stwierdzili, że wirusy mają silniejszą tendencję do nieprawidłowego składania, gdy nad podłożem przepływa więcej białek. Wirusy składające się w ten sposób muszą zrównoważyć tworzenie jądra ze wzrostem kapsydu. Jeśli to pierwsze formuje się zbyt szybko, nie może urosnąć kompletny kapsyd. To spostrzeżenie daje nam pewne wskazówki, jak zaburzyć składanie patogennych wirusów.



Komentarze (0)