Wirus Zika powoduje mikrocefalię, wykorzystując jeden z receptorów
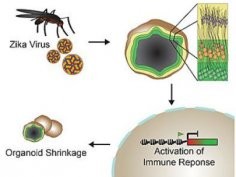
Naukowcy ze Szkoły Medycznej Uniwersytetu Kalifornijskiego w San Diego wykazali, że wirus Zika (ZIKV) aktywuje TLR3, receptor Toll-podobny 3, który bierze udział w wykrywaniu kwasów nukleinowych patogenów. Hiperaktywacja TLR3 wyłącza zaś geny, których komórki macierzyste potrzebują, by zróżnicować się do neuronów i włącza te, które uruchamiają programowaną śmierć komórek - apoptozę.
Gdy podczas eksperymentów na organoidach Amerykanie zahamowali TLR3, zmniejszało to uszkodzenia komórek.
Wszyscy dysponujemy odpowiedzią odpornościową nieswoistą, ale w tym przypadku wirus obraca ją przeciwko nam. Aktywując TLR3, ZIKV blokuje geny, które nakazują komórkom macierzystym, by rozwijały się w różne części mózgu. Dobra wiadomość jest taka, że dysponujemy inhibitorami TLR3, które mogą ograniczyć to zjawisko - wyjaśnia prof. Tariq Rana.
Na początku naukowcy upewnili się, że ich organoidy stanowią dobry model wczesnego rozwoju ludzkiego mózgu. Stwierdzili, że komórki macierzyste modelu różnicują się do rozmaitych neuronów mózgu w ten sam sposób, jak robią to ich odpowiedniki w 1. trymestrze ciąży. Amerykanie porównali też wzorce aktywacji genów w komórkach organoidów z informacjami z baz danych dot. mózgu. Okazało się, że ich model organoidowy w bardzo dużym stopniu przypominał tkankę mózgu płodu w 8.-9. tygodniu od zapłodnienia.
Gdy do trójwymiarowego modelu mózgu dodano prototypowy szczep ZIKV, organoidy uległy skurczeniu. W ciągu 5 dni od zabiegu zdrowe ("infekowane" placebo) organoidy urosły średnio o 22,6%, a zainfekowane zmniejszyły się średnio o 16%.
Amerykanie zauważyli także, że w zarażonych ZIKV organoidach aktywowany był gen TLR3. Funkcją działającego jak antena białka TLR3 jest wykrycie wirusowego dwuniciowego RNA. Gdy się tak stanie, receptor bierze udział w uruchomieniu wiele genów pomagających zwalczyć infekcję. W komórkach rozwijającego się mózgu pobudzenie TLR3 oddziałuje jednak także na 41 innych genów, czego skutkiem jest zmniejszenie różnicowania komórek macierzystych w neurony i nasilona apoptoza.
By ustalić, czy aktywacja TLR3 może być przyczyną wywołanego przez ZIKV obkurczania organoidów, a więc i być może mikrocefalii, akademicy podali do części zainfekowanych organoidów inhibitor TLR3. Okazało się, że związek ten znacząco ograniczył wpływ wirusa na stan komórek i rozmiary organoidów. Poddane "leczeniu" organoidy nadal jednak odczuwały wpływ patogenu; pod jego wpływem zachodziła zwiększona apoptoza, co przejawiało się nierówną zewnętrzną krawędzią.
Choć wyniki są zachęcające, dotąd badania prowadzono wyłącznie na ludzkich i mysich komórkach hodowanych w laboratorium. Poza tym szczep użyty w badaniu (MR766) pochodzi z Ugandy, a obecna epidemia z Ameryki Łacińskiej ma związek z nieco innym szczepem z Azji.
Wykorzystaliśmy ten model wczesnego rozwoju ludzkiego mózgu, by znaleźć mechanizm, za pośrednictwem którego ZIKV powoduje u płodów mikrocefalię. Przewidujemy, że kolejni badacze będą teraz używać tego samego skalowalnego, reprodukowalnego systemu do analizowania innych aspektów zakażenia i testowania potencjalnych leków.



Komentarze (0)