Limofocyty B zaprzęgnięte do walki z nowotworami
Immunoterapia przeciwnowotworowa odgrywa coraz większą rolę w walce z nowotworami. To metoda, która polega na zaprzęgnięciu układu odpornościowego do zwalczania nowotworów.
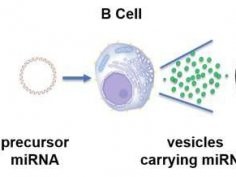
Na University of California San Diego właśnie powstała nowa metoda walki z komórkami nowotworowymi. Tamtejsi naukowcy wykorzystali limfocyty B do produkcji pęcherzyków zawierających mikroRNA. Gdy pęcherzyk zostanie wchłonięty przez komórkę nowotworową, uwalnia gen, który zaburza wzrost guza. U leczonych tą metodą myszy guzy były znacząco mniejsze i było ich mniej niż u zwierząt nieleczonych.
Sądzimy, że w przyszłości metoda ta może posłużyć do leczenia pacjentów, u których zawiodły inne terapie. Dużą zaletą tego podejścia jest fakt, że jest ono zlokalizowane, więc potencjalnie wystąpi tutaj mniej skutków ubocznych. Działa też przed długi czas, zatem pacjent mógłby otrzymać mniej injekcji lub infuzji. Prawdopodobnie też metoda ta będzie działała przeciwko różnym typom nowotworów, w tym nowotworom piersi, jajników, układu pokarmowego, trzustki i rakowi wątrobowokomórkowemu, stwierdził główny autor badań, profesor Maurizio Zanetti.
MikroRNA nie koduje protein. Wiąże za to matrycowy RNA, który koduje proteiny, uniemożliwiając ich kodowanie. W komórkach nowotworowych mRNA jest zwykle mniej aktywne, dzięki czemu komórki te mogą bez przeszkód się rozwijać.
Zanetti i jego zespół wykorzystali miR-335, mRNA, które tłumi aktywność SOX4, czynnika transkrypcji wspomagającego rozwój guzów. W laboratorium dodali prekursor miR-335 do limfocytów B. Limfocyty zamieniły prekursor w dojrzałe aktywne miR-335 i opakowały je w niewielkie pęcherzyki. Każdy limfocyt B produkował w ciągu doby 100 000 pęcherzyków z miR-335. To wystarczająca ilość do zaatakowania 10 komórek nowotworowych.
Podczas testów na myszach naukowcy wszczepili zwierzętom ludzkie komórki nowotworu piersi. Części myszy podano pęcherzyki z miR-335, a części – puste pęcherzyki. Po 60 dniach okazało się, że u 100% myszy (5 na 5) traktowanych pustymi pęcherzykami rozwinęły się duże guzy nowotworowe. Jednocześnie w tym samym czasie guzy pojawiły się u 44% (4 na 9) myszy leczonych pęcherzykami z miR-335. Co więcej przeciętny guz u myszy, którym podawano miR-335 był 260-krotnie mniejszy niż u myszy nieleczonych (7,2 mm3 wobec 1986 mm3). Terapia działała też przez długi czas. Wyższy poziom miR-335 utrzymał się 60 dni po podaniu.
Byliśmy zaskoczeni faktem, że nawet niewielkie zmiany w ekspresji genów komórek nowotworowych, jakie zaszły po podaniu miR-335, były powiązane ze stłumieniem aktywności molekuł koniecznych do rozwoju guza, przyznaje profesor Hannah Carter.
Profesor Zanett mówi, że dalszy rozwój tej metody może przebiegać dwoma drogami. Jedna z nich to pozyskiwanie w laboratorium z limfocytów B pęcherzyków z miR-335 i wprowadzanie ich do organizmu pacjenta. Sposób drugi to wstrzykiwanie samych limfocytów B. Wyzwaniem będzie dostarczenie limfocytów B czy pęcherzyków w sąsiedztwo guza. Łatwiej będzie to uczynić tam, gdzie guz jest dostępny i można użyć strzykawki. Jednak wiele guzów jest umiejscowionych w trudno dostępnych miejscach. Dlatego też Zanetti i jego zespół pracują obecnie nad udoskonaleniem metod dostarczenia leku, zwiększenia jego skuteczności i zmniejszenia skutków ubocznych.
Idealnie byłoby, gdybyśmy w przyszłości byli w stanie sprawdzać pacjentów pod kątem poziomu miR-335 i SOX4. Wtedy leczylibyśmy tylko tych, u których byłaby największa szansa na powodzenie naszej terapii. To właśnie nazywamy spersonalizowaną precyzyjną medycyną. Można też dostosować tę technikę do użycia z innymi typami mRNA i atakowania innych komórek nowotworowych, dodaje uczony.



Komentarze (0)