Proteina zwalczająca raka przeprojektowana tak, że nie ma skutków ubocznych
Dla pacjentów z agresywnymi formami raka nerki czy skóry jedynym ratunkiem może być interleukina-2, która wzmaga odpowiedź układu odpornościowego. Problem jednak w tym, że aby skutecznie zwalczała ona raka trzeba zastosować dawki, które zagrażają życiu pacjenta. Naukowcy z University of Washington wykorzystali model komputerowy do zaprojektowania od początku nowej proteiny, która równie skutecznie jak IL-2 zwiększa odpowiedź układu odpornościowego, ale jest pozbawiona skutków ubocznych interleukiny. Na razie nową proteinę z powodzeniem przetestowano na zwierzętach.
IL-2 to cytokina zwiększająca odpowiedź limfocytów T poprzez jednoczesne przyczepianie się do ich receptorów IL-2β oraz IL-2γ. Jeśli komórka posiada receptor IL-2α interleukina-2 łączy się również z nim. Może to się przydarzyć w komórkach budujących naczynia krwionośne, co powoduje, że zaczynają one przeciekać, a to zagraża życiu pacjenta.
Od 30 lat naukowcy próbują zmienić IL-2 w bardziej bezpieczną i efektywną, mówi Daniel Adriano Silva Manzano, biochemik z University of Washington i główny autor najnowszych badań. Jednak trudno jest dokonać zmian w IL-2, gdyż jest bardzo niestabilna i przestaje działać, gdy traci swoją zwykłą strukturę, a kolejne mutacje mogą ją jeszcze bardziej destabilizować.
Silva Manzano poprosił o pomoc Davida Bakera, projektanta białek i dyrektora laboratorium na swojej uczelni, oraz zwerbował do pomocy kolegów z USA, Portugalii, Hiszpanii i Wielkiej Brytanii. Ich celem było stworzenie od podstaw nowej proteiny przypominającej IL-2.
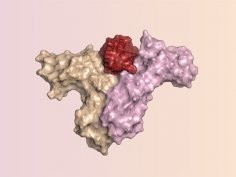
Naukowcy zaczęli pracę od przeanalizowania na poziomie atomowym sposobu interakcji IL-2 z receptorami α, β i γ. Gdy IL-2 zwija się w aktywny kształt 3D tworzy cztery segmenty o kształcie spirali. W miejscu, gdzie spirale łączą się ze sobą znajdują się dwa miejsca, które wiążą się z receptorami β i γ. Z receptorem α łączy się część jednej ze spiral oraz dwa miejsca łączenia spiral.
Naukowcy wykorzystali stworzone przez Bakera oprogramowanie o nazwie Rosetta. Ich celem było zaprojektowanie takiego białka, które łączyłoby się z receptorami β i γ, ale nie miałoby elementów łączących je z receptorami α. Rosetta zaproponowała 40 różnych rozwiązań. Po ich przeanalizowaniu naukowcy wybrali 22 białka, które zsyntetyzowali i przetestowali.
W końcu wybrali wersję nazwaną przez siebie Neo-2/15. Jedynie 14% sekwencji jej aminokwasów jest identyczna z IL-1. Badania laboratoryjne wykazały, że nowe białko ściśle łączy się z receptorami β i γ, ale nie z receptorami α. Podczas testów na myszach z nowotworami jelita grubego i czerniakiem nowa proteina wykazywała znacznie mniejsze skutki uboczne niż IL-2, silnie hamowała wzrost guza, a u niektórych zwierząt doprowadziła nawet do zniknięcia guzów nowotworowych. Dała więc lepsze skutki niż interleukina-2, której podawanie nie likwidowało guzów.
Jeśli testy kliniczne Neo-2/15 przebiegną równie pomyślnie, to onkolodzy zyskają nowy środek, który będzie można stosować dłużej, dzięki czemu organizm pacjenta będzie miał więcej czasu, by pozbyć się nowotworu. Niewykluczone, że jeszcze bardziej skuteczne może być połączenie Neo-2/15 z inhibitorami punktów kontrolnych.
University of Washington licencjonował Neo-2/15 firmie Neoleukin Therapeutics, która pracuje nad rozpoczęciem testów klinicznych. Zatrudnieni w niej naukowcy poszukują obecnie sposobu na jeszcze większe zredukowanie skutków ubocznych nowego środka tak, by układ odpornościowy atakował jedynie komórki guza, a nie zdrowe komórki.



Komentarze (0)